Extras din proiect
CAP. I. INTRODUCERE
Aceasta este starea de oxidare dominanta a manganului. Este starea de oxidare stabila a hexaacvomanganului si aproape a tuturor “sarurilor” care se gasesc în sticlele de reactivi în laborator. Desi multe, nu toate speciile de mangan (II) pot fi oxidate rapid si chimia manganului (III) si a manganului (IV) a capatat o atentie sporita, aceste specii sunt utilizate ca agenti de oxidare. Pe de alta parte, reducerea la mangan (I) este neobisnuita, cu exceptia liganzilor cu carbon si este în mod aparent imposibila pentru speciile cu donori oxigen, azot sau halogen.
Manganul este primul metal tranzitional pentru care +2 este starea de oxidare “obisnuita”. Aceasta este o caracteristica a metalelor tranzitionale din prima serie de tranzitie de la fier la zinc. Prin comparatie cu cei doi vecini ai sai din dreapta si din stânga – cromul si fierul – manganul (II) este mai stabil decât este de asteptat. Aceasta este în mod obisnuit atribuita orbitalului d stabil ocupat pe jumatate cu electroni ai compusilor cu spin înalt.
Diagramele starilor de oxidare din figura nr.1 dau o perspectiva asupra stabilitatii relative a manganului (II) pentru liganzii OH2, OH- si O2-.
În multe din caracteristicile sale, chimia manganului (II) cuprinde pe cele ale metalelor alcalino-pamântoase (în special magneziu (II) si pe cele ale metalelor tranzitionale din primul rând al tabelului). Exista, de asemenea, paralele mai mult cu cadmiul (II) decât cu zincul (II). Acestea toate se refera la o mult mai semnificativa legatura ionica pentru mangan si la dimensiunea “ionului” de metal.
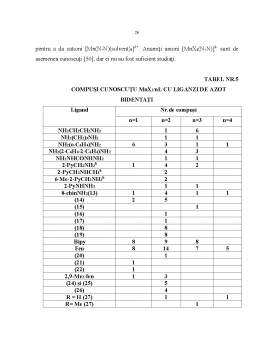
Manganul (II) este în mod distinct un metal de clasa (a) [1]. Acestea se manifesta, de exemplu, în preferinta pentru liganzi cu O donor mai mult decât pentru liganzi cu N donor, astfel încât aminoacizii se vor lega în special prin O gruparii carboxil. Despre liganzii cu P sau As se cunosc mai putine date, desi cercetarile recente sugereaza posibilitatea ca acestia sa devina unul din cele mai importante domenii ale chimiei MnII. Despre liganzii de S se cunosc înca putine date desi acestia dau impresia de dificultate în obtinerea compusilor puri din cauza labilitatii si a stabilitatii reduse.
Situatia starii mangan – sulf este rezumata în afirmatia prin care se arata ca o lucrare recenta contribuie enorm la cunoasterea acestui domeniu.
Labilitatea marcanta a speciilor de mangan (II) este fara îndoiala unul din motivele pentru neglijarea chimiei manganului. Labilitatea, adesea cuplata cu stabilitatea redusa a speciilor, este un argument ca exista o corelare redusa între solutii si solide, si adauga o incertitudine la acest domeniu al chimiei care este în mare masura absent în chimia compusilor inerti.
Starea de spin a celor mai multi compusi de mangan (II) este starea d5 maxim cu o stare fundamentala – câteva exceptii cunoscute sunt notate în text (vezi de asemenea tabelul nr.1).
Geometriile de coordinare sunt în totalitate variabile; si în concordanta cu lipsa de CFSE pentru configuratia spin maxim d5, efectele sterice de ligand si efectele electronice par sa joace un rol imporant în definirea acestor geometrii.
Numarul de coordinare 6 apare din date disponibile limitate, cele mai obisnuite (tabel nr.1). Numere de coordinare mai mici sunt cunoscute, dar par sa fie într-adevar rare: numarul 3 este reprezentat în anumite sililamide si într-un zeolit deshidratat; numarul de coordinare planara 4 este cunoscut numai pentru sistemele macrociclice [N4] si [MnO4] în câtiva compusi cristalini neobisnuiti; numarul de coordinare tetraedrica 4 este bine caracterizat, dar aparent este mai putin obisnuit decât pentru Zn, Co si chiar pentru Ni nmarul de coordinare 5 este de asemenea cunoscut, dar câteva exemple nu sunt înca carcterizate.
Preview document
Conținut arhivă zip
- Combinatii Complexe ale Mn(II) cu Liganzi Donori Azot
- bibliografie.doc
- cap1.doc
- cap2.doc
- cap3.doc
- chimie4.doc
- cuprins.doc
- univ.doc































































![Compuși de tipul [M-M2S2]Z în chimia coordinativă](https://s.r-l.ro/fat/62/4/7/7/47795.jpg)

