Extras din referat
Procesul electrodepunerii straturilor compozite consta din inglobarea particulelor solide, aflate in suspensie intr-o baie de electrodepunere, in metalul care electrocristalizeaza si care constituie matricea metalica. Aceste particule sunt considerate insolubile. Codepunerea electrochimica nu poate fi privita ca un process electrochimic separate de electrodepunerea metalului insusi.
Particulele care pot fi codepuse cu metalele pot fi si ele sumar clasificate in doua tipuri:
- Materiale hidrofile, cu suprafata hidrolizabila. in care se incadreaza cuartul si in general oxizii;
- Materiale hidrofobe, in care se incadreaza materialele plastice, grafitul, carburile si nitrurile.
Este de asteptat. deci, ca un anumit tip de material codepus in cele trei tipuri de metale sa aiba efecte diferite asupra mecanismului si stratului electrodepus. De asemenea, particulele cu suprafete hidrofile vor avea efecte diferite fata de particulele cu suprafete hidrofobe, atat in mecanismul electrodepunerii metalului cat sj in comportarea stratului compozit in diferite medii corozive.
Pentru studiul influentei codepunerii particuleleor cu metalele in obtinerea straturilor compozite s-au ales trei metale din cele trei grupe: zincul. nichelul si cuprul. Ca particule disperse s-au utilizat oxizii: de zirconiu (ZrO2), de titan (TiO2), si de aluminiu (γ- Al2O3), pentru comparatie cunoscuti ca particule ceramice cu rezistenta buna la agentii corozivi si la temperatura ridicata. In cazul nichelului s-a studiat comparativ si codepunerea carburii de siliciu (SiC). Principalele caracteristici ale particulelor utilizate ca faze disperse sunt prezentate in tabelul de mai jos.
Permitivitatea dielectrica (s), sau constanta dielectrica, a acestor faze disperse prezinta valori apropiate. respectiv: 10,4 pentru oxidul de aluminiu. 12,5 pentru oxidul de zirconiu, 11,5 pentru oxidul de titan sj 10,2 pentru carbura de siliciu. Toate particulele utilizate ca faze disperse sunt semiconductori de tip n. Oxidul de aluminiu este un izolator, fara electroni liberi in banda de conductie. Permitivitatea sau constanta dielectrica a metalelor este considerata infinita.
In contrast cu interfata metal/electrolit concentratia purtatorilor de sarcina intr-o faza semiconductoare este foarte scazuta, si constanta dielectrica are O valoare finita. In aceste conditii, la interfata semiconductor/electrolit, in momentul introducerii particulelor disperse in electrolit, se formeaza doua straturi dublu-electric. difuze: unul in electrolit si unul in semiconductor.
Distributia sarcinii intr-un semiconductor se refera la O regiune spatiala incarcata , sau strat de sarcina spatiala. Echilibrul la interfata oxid/solufie va fi obtinut printr-o redistribute a electronilor si gaurilor prin miscarea regiunii spatiale incarcate a semiconductorului si a ionilor si dipolilor in regiunea dublului strat electric al solutiei. Astfel O cadere de potential exista in aceasta regiune spatiala de sarcina.
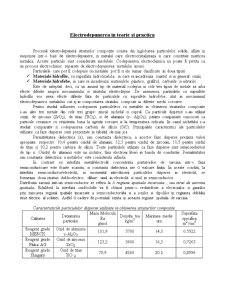
Caracteristicile particulelor disperse utilizate in obtinerea straturilor compozite
Calitatea Denumirea particulei Masa Molecula Ra
g/mol Densita tea
kg/m3 Marimea medie urn Suprafata specifica
m2 /cm3
Reagent grade MERCK Oxid de aluminiu γ-Al2O3 101,9 3700 14,3 0.5922
Reagent grade Fluka AG Oxid de zirconiu
ZrO2 123,2 5600 16,5 0,7263
Reagent grade Hungary Oxid de titan
TiO 2 79,9 4260 20.2 0,8996
Reagent grade Hungary Carbura de siliciu SiC 40,1 3217 600 mesh -
Banda de energie (conductie si banda de valenta) se indreapta in jos pentru semiconductorii de tip p si in sus pentru semiconductorii de tip n. Energia electronilor in interiorul semiconductorului departe de sarcina spatiala este potentialul de banda plat, unde electronii si vacantele sunt in starea de echilibru. Capacitanta totala diferentiala este suma capacitantei sarcinii spatiale si a capacitantei stratului dublu electric.
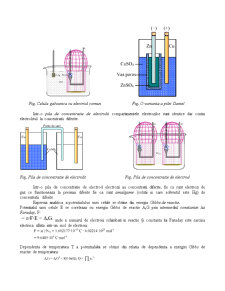
Celule electrochimice
Speciile chimice se pot studia pe baza reactiilor pe care acestea le au in solutie. O metoda convenabila in acest sens este efectuarea de masuratori electrochimice.
Aparatul de baza este o celula electrochimica si consta din 2 electrozi sau conductori metalici in contact cu un electrolit, care este un conductor ionic. Conductorul ionic poate fi o solutie, un lichid sau un solid.
Electrodul impreuna cu electrolitul sau formeaza compartimentul de electrod, ceea ce nu exclude ca uneori electrozii sa se gaseasca in acelasi compartiment.
Fig. Celule electrochimice
Exista doua tipuri de celule electrochimice:
- celule (pile) galvanice, in care se produce electricitate ca urmare a reactiei chimice spontane ce are loc in interiorul celulei;
- celule electrolitice, in care au loc reactii chimice prin aplicarea unei surse exterioare de curent si care au electrolit comun.
Transferul de electroni poate fi insotit si de alte procese chimice cum ar fi transferul speciilor chimice, insa fenomenul dominant este transferul de electroni.
Preview document
Conținut arhivă zip
- Electrodepunerea in Teorie si Practica.doc