Extras din curs
Caracterizare generală
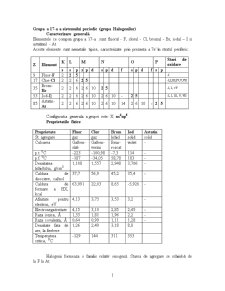
Elementele ce compun grupa a 17-a sunt: fluorul - F, clorul - Cl, bromul - Br, iodul – I si astatinul - At.
Aceste elemente sunt nemetale tipice, caracterizate prin prezenta a 7e- în stratul periferic.
Z Element K L M N O P Stari de oxidare
s s p s p d s p d f s p d f s p
9 Fluor-F 2 2 5 -I
17 Clor-Cl 2 2 6 2 5 -I,I,III,IV,V,VII
35 Brom-Br 2 2 6 2 6 10 2 5 -I, I, +V
53 Iod-I) 2 2 6 2 6 10 2 6 10 - 2 5 -I, I, III, V, VII
85 Astatin-At 2 2 6 2 6 10 2 6 10 14 2 6 10 - 2 5
Configuratia generala a grupei este: X: ns2np5.
Proprietatile fizice
Proprietate Fluor Clor Brom Iod Astatin
St. agregare gaz gaz lichid solid solid
Culoarea Galben-slab Galben-verzui Brun-roscat violet -
p.t. 0C -223 -100,98 -7,3 114 -
p.f. 0C -187 -34,05 58,78 183 -
Densitatea lichidului, g/cm3 1,108 1,557 2,948 3,706 -
Caldura de disociere, cal/nol 37,7 56,9 45,2 35,4 -
Caldura de formare a HX, kcal 63,991 22,03 8,65 -5,926 -
Afinitate pentru electron, eV 4,13 3,75 3,53 3,2 -
Electronegativitate 4,15 3,10 2,85 2,45 -
Raza ionica, Å 1,33 1,81 1,96 2,2 -
Raza covalenta, Å 0,64 0,99 1,11 1,28 -
Densitate fata de aer, la fierbere 1,26 2,49 3,18 8,8
Temperatura critica, 0C -129 144 311 553
Halogenii formeaza o familie relativ omogenă. Starea de agregare se schimbă de la F la At.
F2, Cl2 – gaze
Br2 – lichid
I2, At2 – solid
Culoarea se intensifică cu creşterea masei moleculare (atomice), densitatea, indicele de refracţie, punctele de topire şi de fierbere, căldurile de topire, raza ionică cresc odată cu creşterea numărului de ordine.
Cel mai instabil este fluorul şi instabilitatea scade de la fluor la iod. In stare gazoasă toate moleculele sunt diatomice. Stabilitatea moleculei scade de la fluor la iod.
In moleculele diatomice X2, atomii sunt uniţi printr-o legatură de tip σ la molecula F2, sau şi legatura π formate prin intrepătrunderea orbitalului vacant de tip d de la unul din atomi cu orbitalul de tip p ocupat cu 2e- de la celălalt atom – la Cl2 si Br2.
Afinitatea pentru e- scade cu creşterea numărului atomic, Z, în acord cu creşterea numărului de straturi electronice cu rol în ecranarea acţiunii nucleului şi cu creşterea volumului atomic.
X2 + 2e- ↔ 2X-
F2 este cel mai electronegative element şi deci cel mai puternic agent oxidant.
Halogenii pot forma legături ionice sau covalente, în egală măsură, în funcţie de elementele cu care se combină.
Halogenii formează legături covalente cu elemente slab electronegtiv: C, Si, P, As, O, S, B precum şi cu metalele în stări de oxidare superioare Pb(IV), V(V), Cr(VI).
Fluorul, primul element al grupei, se deosebeşte de ceilalţi halogeni:
- este mult mai reactiv decât ceilalţi halogeni F>Cl>Br>I
- reactivitatea mare a moleculei F2 se datorează pe de o parte energiei mici de legatură care permite o rupere uşoară a moleculei iar pe de altă parte faptului că este cel mai electronegativ element
- are numai starea de oxidare –1
Cl, Br, şi I formează combinaţii şi la stări de oxidare pozitive numai cu doua elemente mai electronegative decat ele: F si O. Aceste legături sunt de tip sigma (hibridizare sp3 sau chiar sp2 la Cl, Br şi I) şi legaturi π ale acestor elemente (O,F).
Stabilitatea combinatiilor cu O2 în funcţie de starea de oxidare, variază în ordinea +III< +V< +VII
Singurul compus cu oxigenul, nestabil al unui halogen la starea de oxidare +III este acidul cloros, HClO2, iar cel mai stabil este ionul perclorat ClO-4 (Cl are starea de oxidare +VII).
Toate elementele prezintă mai mulţi izotopi
- F şi I au câte un singur izotop natural 19F şi 127I
- Cl şi Br au câte doi izotopi 35Cl, 37Cl şi 79Br, 81Br
- Prezintă numeroşi izotopi artificiali radioactivi.
Fluorul
Simbol F Număr atomic, Z = 9 Număr de masa, A = 19 Masa atomica
Stare naturală – din cauza reactivităţii sale nu se mai gaseşte in natura în stare liberă ci doar sub formă de săruri simple, duble şi complexe.
- CaF2 – fluorina este cea mai importantă fluorură simplă
- Na3[AlF6] criolita, hexafluoroaluminatul de sodium, este cea mai importanta fluorura complexa
- Ca3(PO4)2, Ca(F,Cl)2 apatita cea mai importantă fluorură dublă
- se mai găseşte combinat în topaz, orpiment, mică, pământuri rare
- în corpul omenesc şi al animalelor - în oase, dinţi, unghii, sub formă de apatita
Metode de obtinere
Singura metodă de preparare a fluorului este oxidarea electrolitică
2F- - 2e- = 2F = F2
Fluorurile nu pot fi electrolizate în stare de topitură datorită punctelor de topire prea ridicate (NaF – 998 0C) şi nici sub forma soluţiilor apoase deoarece fluorul reacţionează imediat cu apa.
Metoda Moissau (1886) electroliza unui amestec de substanţe: KI si HF anhidru. Deoarece fluorul atacă sticla, vasul de electroliză trebuie să fie din platină, cupru, grafit, magneziu iar electrozii din Ni sau grafit.
Preview document
Conținut arhivă zip
- Nemetale - Grupa a XVII-a.doc