Cuprins
- 1. Structura compusilor organici
- 1.1 Obiectul chimiei organice pag.3
- 1.2 Compozitia compusilor organici 3
- 1.3 Legaturi chimice in compusii organici 4
- 1.4 Catene de carbon 9
- 1.5 Formule structurale 10
- 1.6 Clasificarea compusilor organici 11
- 2. Hidrocarburi
- 2.1 Alcani 13
- 2.2 Cicloalcani 19
- 2.3 Alchene 23
- 2.4 Diene si poliene 30
- 2.5 Poliene cu structura izoprenica 34
- 2.6 Alchine 38
- 2.7 Hidrocarburi aromatice 41
- 3. Compusi organici cu functiuni simple
- 3.1 Compusi halogenati 48
- 3.2 Alcooli 52
- 3.3 Fenoli 62
- 3.4 Amine 70
- 3.5 Compusi carbonilici 78
- 3.6 Acizi carboxilici 85
- 3.7 Esteri 96
- 3.8 Acizi grasi si acilgliceroli 99
- 4. Coloranti alimentari 109
- Bibliografie 111
Extras din curs
1.1 OBIECTUL CHIMIEI ORGANICE
Obiectul de studiu al chimiei organice il reprezinta:
-Izolarea si purificarea substantelor organice naturale sau sintetice
-Determinarea compozitiei calitative si cantitative prin analiza elementala
-Determinarea proprietatilor fizice si chimice
-Stabilirea structurii chimice
-Sinteza industriala sau de laborator
1.2. COMPOZITIA COMPUSILOR ORGANICI
Compusii organici sunt alcatuiti dintr-un numar relativ mic de elemente chimice,numite elemente organogene.
Elementele organogene,in ordinea decrescatoare a frecventei sunt;
C,H,O,N,Cl,S,P,Br,I,F,Si,metale(Na,Li.Mg,Fe,Co,Cu,Zn,Pb).
Toti compusii organici contin carbon in molecula,motiv pentru care chimia organica este denumita ca fiind chimia compusilor carbonului..Majoritatea substantelor organice contin hidrogen in molecula(exista cca.600 compusi organici fara hidrogen).
Compozitia compusilor organici se determina prin analiza elementala .Prin analiza elementala calitativa se identifica elementele organogene,iar prin analiza elementala cantitativa se determina proportia elementelor care intra in compozitia substantei analizate.
Principiul analizei elementale organice consta in transformarea compusilor organici in compusi anorganici(proces de mineralizare sau de dezagregare),care se identifica si se dozeaza prin metode specifice chimiei anorganice.
Identificarea carbonului si a hidrogenului dintr-un compus organic se face prin oxidarea acestora,folosind oxidul de cupru sau dioxidul de mangan care au rol de oxidanti si de catalizatori.
Substanta(C,H) + CuO → CO2 + H 2 O + Cu
Exemplu: C6 H12 O6 + 12 CuO → 6CO2 + 6H2 O + 12 Cu
Bioxidul de carbon se identifica sub forma de BaCO3 sau CaCO3,iar apa se identifica ub forma de picaturi pe peretii eprubetei.
Pentru identificarea azotului,sulfului si halogenilor,substanta organica se mineralizeaza cu sodiu,cand se formeaza compusi anorganici,usor de identificat prin reactii simple si specifice.
Substanta(C,H,N,S,X) + Na → NaCN + Na2S+ NaX
Ionul cian se identifica sub forma de albastru de Berlin,ionul sulfura se identifica sub forma de sulfura de plumb,iar ionul halogenura sub forma de halogenura de argint.
Fig.1 Identificarea C si H
Formule brute si formule moleculare
Din datele analizei elementale calitative si cantitative se determina formula procentuala si formula bruta(empirica)
Exemplu:40%C,6,66%H,53,34%O si masa molara 60 g/mol
Formula bruta indica felul si raportul numeric dintre atomii componenti:(CH 2O)n
Formula moleculara sau reala reprezinta tipul si numarul real al atomilor componenti dintr-o molecula C2 H 4O2 .
Formula moleculara este fie egala,fie multiplu intreg al formulei brute.
Oxigenul organic se determina indirect,prin diferenta.
1.3 LEGATURI CHIMICE IN COMPUSII ORGANICI
Legaturile chimice(legaturile de valenta) reprezinta interactiile reciproce care se stabilesc intre atomii elementelor chimice prin intermediul electronilor de valenta,cand dobandesc configuratie de gaz inert.
Atomii de carbon formeaza legaturi covalente intre ei,cat si cu atomii altor elemente organogene.
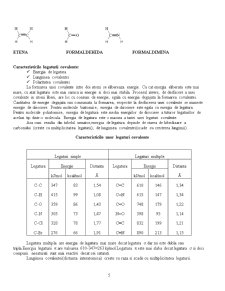
Conform teoriei electronice a covalentei(teoria lui Lewis),legatura covalenta se stabileste intre atomii elementelor cu caracter electrochimic apropiat, prin punerea in comun a unu,doi sau trei electroni de valenta .Se formeaza astfel o covalenta simpla,dubla,respectiv tripla.
sau
ETENA FORMALDEHIDA FORMALDIMINA
Caracteristicile legaturii covalente:
-Energia de legatura
-Lungimea covalentei
-Polaritatea covalentei
La formarea unei covalente intre doi atomi se elibereaza energie. Cu cat energia eliberata este mai mare, cu atat legatura este mai saraca in energie si deci mai stabila. Procesul invers, de desfacere a unei covalente in atomi liberi, are loc cu consum de energie, egala cu energia degajata la formarea covalentei. Cantitatea de energie degajata sau consumata la formarea, respectiv la desfacerea unei covalente se numeste energie de disociere. Pentru molecule biatomice, energia de disociere este egala cu energia de legatura. Pentru molecule poliatomice, energia de legatura este media energiilor de disociere a tuturor legaturilor de acelasi tip dintr-o molecula. Energia de legatura este o masura a tariei unei legaturi covalente.
Asa cum rezulta din tabelul urmator,energia de legatura depinde de starea de hibridizare a carbonului (creste cu multiplicitatea legaturii), de lungimea covalentei(scade cu cresterea lungimii).
Preview document
Conținut arhivă zip
- Chimie Organica.doc