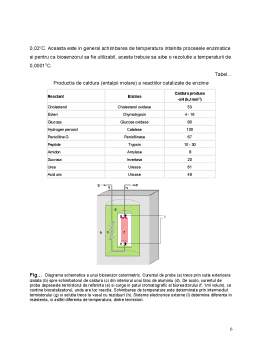
Extras din curs
3.2 Imobilizarea enzimelor prin reticulare.
Imobilizarea enzimei se poate realiza şi fără a se utiliza suporturi prin efectuarea de punţi covalente cu ajutorul unor reactivi polifuncţionali. Se obţin astfel structuri cu înaltă masă moleculară care devin insolubile. Pentru realizarea unei astfel de reacţii se pot folosi numeroşi reactivi, dintre care cei mai utilizaţi sunt :
Principalii reactivi polifuncţionali
Nume Structură
Glutaraldehidă
Acid bis-diazobenzidin-2,2’-disulfonic
Acid difenil-4,4’-diizotiocianat-2,2’-disulfonic
1,5-difluoro-2,4-dinitro-benzen
3-metoxi-4,4’-difenil diizotiocianat-metan
De departe glutaraldehida este reactivul cel mai utilizat nu numai pentru a se reticula enzimele ci şi pentru realizarea aşa numiţii imuno-adsorbanţi.
În acest proces enzima este diluată cu o proteină inertă, cum este albumina, pentru a se limita fenomenele de denaturare şi a creşte eficacitatea metodei de imobilizare. Derivaţii rezultaţi pot fi şi sub formă de membrane. Observaţii la microscopul electronic au permis precizarea structurii fine a acestor tipuri de derivaţi.
Pentru obţinerea unor derivaţi cu o structură foarte poroasă asemănătoare bureţilor, amestecul de enzimă, albumină şi glutaraldehidă este congelat rapid după care se creşte temperatura până la 40C în mod lent.
Un astfel de proces de reticulare se poate aplica nu numai enzimelor ci şi celulelor întregi. Acestea prezintă avantajul, mai ales în cazul în care celula conţine o enzimă uşor accesibilă (cum este cazul enzimelor periplasmatice), că permit utilizarea activităţii catalitice fără a se efectua procesele de extracţie şi purificare consumatoare de energie, timp şi bani. În acest caz putem spune că celula este suportul. De asemenea se evită eliberarea sistemelor care determină autodegradarea celulară printr-o încălzire a sistemului timp scurt la o temperatură de 700- 800C. În plus acest procedeu permite scăderea importantă a costului enzimei imobilizate şi este utilizat pe larg pentru imobilizarea glucoz izomerazei folosită pentru producerea de izoglucoză, una dintre cele mai importante aplicaţii industriale de enzime imobilizată.
De exemplu cu glutaraldehidă firma NOVO a reticulat Bacillus coagulans, iar GIST-BROCADES micelii de Actinoplanes missouriensis.
Avantaje şi dezavantaje
Avantaje
- Soliditatea legăturii enzimă –suport care permite obţinerea de compuşrezistenţi la diferite variaţii importante ale condiţiilor de mediu (pH, tărie ionică) şi, în particular, la spălări repetate cu soluţii concentrate de clorură de sodiu.
- Există o foarte mare varietate de suporturi şi metode de activare, deşi este aproape imposibil de a prevedea a priori eficacitatea unei metode de imobilizare, este întotdeauna posibil să se găsească pentru o enzimă dată o metodă care să dea un randament de imobilizare bun.
- Stabilitatea legăturilor covalente între enzimă şi suport se poate traduce şi prin rigidificarea structurii tridimensionale a enzimei. Din aceasta rezultă noi proprietăţi, în special printr-o creştere generală a rezistenţei la factorii de denaturare(temperatură, pH, agenţi denaturanţi). Este semnificativ că foarte multe enzime imobilizate prezintă o temperatură optimă de activitate mai mare decât a enzimei libere fapt deosebit de important pentru utilizarea enzimei în flux continuu. Pentru ca rigidificarea enzimei să nu fie totală, fiind necesară o anumită elasticitate, este obligatoriu să se stabilească condiţiile optime de imobilizare pentru fiecare enzimă în parte şi pentru fiecare procedură de imobilizare.
Dezavantaje
- Imobilizarea prin legare covalentă este mult mai complexă decât prin incluziune sau adsorbţie. Chimia heterogenă aplicată pentru a se ajunge la imobilizare nu duce întotdeauna la rezultatele aşteptate considerând reacţiile care au loc în fazele omogene ca urmare a fenomenelor de interferenţă din micromediul înconjurător prezent în sistemele heterogene.
- Formarea legăturilor covalente între diferitele grupări funcţionale ale enzimei şi suportului conduce la o importantă modificare a structurii enzimei, care deşi este benefică în ceea ce priveşte ameliorarea rezistenţei la factori de denaturare, provoacă totuşi o denaturare a structurii moleculei enzimei. De aceea randamentul de imobilizare exprimat în funcţie de activitatea enzimatică reziduală poate avea valori procentuale de la câteva unităţi la mai mult de 90%. De exemplu este suficient ca la legătură să participe şi grupări din situsul catalitic al enzimei ca activitatea sa să fie perturbată. De asemenea pot fi amintite şi efectele de stânjenire sterică şi de schimbare a sensibilităţii enzimei la variaţii de pH saiu chiar la modificarea valorii optime de pH.
Preview document
Conținut arhivă zip
- Enzimologie Speciala
- curs xiii.doc
- curs xiv.doc
- curs xix.doc
- curs xv.doc
- curs xvi.doc
- curs xvii.doc
- curs xviii.doc
- curs xx.doc
- curs xxi.doc
- curs xxii.doc
- curs xxiii.doc