Extras din curs
Metodele titrimetriei prin reacții acido-bazice (cu transfer de protoni) se bazează pe interacțiunea dintre substanțe cu caracter acid și substanțe cu caracter alcalin :
H+ + OH- = H2O
În funcție de titrantul utilizat se deosebesc :
- metode alcalimetrice (titrantul este o soluție de bază :NaOH, KOH) ;
- metode acidimetrice (titrantul este o soluție de acid : HCl, H2SO4).
Procesul de titrare poate fi urmărit după variația pH-ului soluției ( pH = -lg [H+] ) la adaos de titrant.
Pentru aprecierea vizuală a sfârșitului titrării se folosesc frecvent indicatori acido-bazici de culoare. Aceștia sunt substanțe organice cu caracter de acid slab (sau bază slabă), care își modifică culoarea în funcție de pH-ul sistemului titrat - titrant (formele disociată și nedisociată ale indicatorului au culori diferite).
Indicatorii acido-bazici de culoare se caracterizează prin interval (domeniu) de viraj, ce reprezintă intervalul de pH în care se produce schimbarea de culoare.
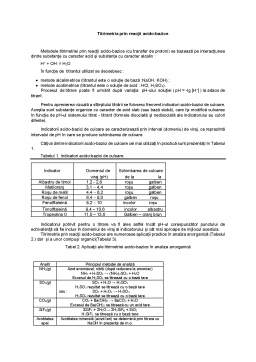
Câțiva dintre indicatorii acido-bazici de culoare cei mai utilizați în practică sunt prezentați în Tabelul 1.
Tabelul 1. Indicatori acido-bazici de culoare
Indicator
Domeniul de
viraj (pH)
Schimbarea de culoare
de la la
Albastru de timol
1,2 - 2,8
roșu galben
Metiloranj
3,1 - 4,4
roșu galben
Roșu de metil
4,4 - 6,2
roșu galben
Roșu de fenol
6,4 - 8,0
galben roșu
Fenolftaleină
8,2 - 10
incolor roșu
Timolftaleină
9,4 - 10,6
incolor albastru
Tropeolina 0
11,0 - 13,0
Galben - oranj brun
Indicatorul potrivit pentru o titrare va fi ales astfel încât pH-ul corespunzător punctului de echivalență să fie inclus în domeniul de viraj al indicatorului și cât mai aproape de mijlocul acestuia.
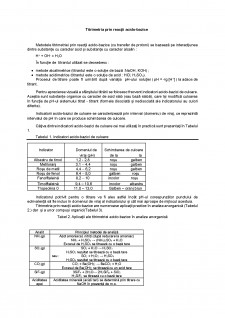
Titrimetria prin reacții acido-bazice are numeroase aplicații practice în analiza anorganică (Tabelul 2.) dar și a unor compuși organici(Tabelul 3).
Tabel 2. Aplicații ale titrimetriei acido-bazice în analiza anorganică
Analit
Principiul metodei de analiză
NH3(g)
Azot amoniacal, nitriți (după reducere la amoniac)
NH3 + H2SO4 - (NH4)2SO4 + H2O
Excesul de H2SO4 se titrează cu o bază tare
SO2(g)
SO2 + H2O - H2SO3
H2SO3 rezultat se titrează cu o bază tare
sau : SO2 + H2O2 - H2SO4
H2SO4 rezultat se titrează cu o bază tare
CO2(g)
CO2 + Ba(OH)2 - BaCO3 + H2O
Excesul de Ba(OH)2 se titrează cu un acid tare
SiF4(g)
3SiF4 + 2H2O- 2H2SiF6 + SiO2
H2SiF6 se titrează cu o bază tare
Aciditatea apei
Aciditatea minerală (acizii tari) se determină prin titrare cu NaOH în prezență de m.o.
Aciditatea totală (H2CO3 + acizi tari) se determină prin
titrare cu NaOH în prezență de ff.
Alcalinitatea
apei
Alcalinitatea permanentă (Hidroxizi + carbonați) se
determină prin titrare cu HCl în prezență de ff.
Duritatea
temporară
Ca(HCO3)2 și Mg(HCO3)2 se determină prin titrare cu HCl
în prezență de m.o.
Tabelul 3. Aplicații ale titrimetriei acido-bazice în analiza unor compuși organici
Analit Reacția ce produce acidul sau baza ce
urmează a fi titrat(ă)
Titrare
Acizi
organici
RCOOH + NaOH - RCOO Na + H2O directă
Baze
organice
RNH2 + HCl - RNH3
+] Cl- directă
Esteri
RCOOR` + NaOH - RCOO Na + R`OH
NaOH (exces)
cu un acid tare
Compuși
carbonilici
R2C=O + NH2OH - HCl -
- R2C=NOH + HCl + H2O
HCl cu o bază
tare
Alcooli ROH + (CH3CO)2O - CH3COOR +
CH3COOH
CH3COOH cu
o bază tare
Nitrili R-C≡N + NaOH + H2O - RCOONa + NH3 NH3 cu un
acid tare
Preview document
Conținut arhivă zip
- Titrimetria prin reactii acido-bazice.pdf