Cuprins
- 1. Lucrări practice de calorimetrie 2
- 1.1. Determinarea calorimetrică a entalpiei de vaporizare a lichidelor 2
- 1.2. Determinarea calorimetrică a entalpiei de neutralizare 7
- 2. Studiul echilibrului de faze 11
- 2.1. Studiul echilibrului solid-lichid. Analiza termică 11
- 2.1.1. Determinarea diagramei de echilibru pentru un sistem
- cu punct eutectic (fenol-uree) 12
- 2.1.2. Determinarea diagramei de echilibru pentru un sistem
- binar care formează soluţie solidă 16
- 2.2. Studiul echilibrului lichid-lichid 19
- 2.2.1. Distribuţia unui solvent între două lichide nemiscibile.
- Coeficientul de repartiţie 19
- 2.2.2. Determinarea diagramei de miscibilitate a sistemului fenol-apă 22
- 2.2.3. Sistem ternar. Curba de solubilitate a unui sistem ternar 26
- 3. Echilibrul chimic 29
- 3.1. Determinarea experimentală a constantei de echilibru a reacţiei
- KI + I2 KI3 prin metoda distribuţiei 29
- 3.2. Demonstrarea comportamentului dinamic al sistemelor de reacţii
- dinamice cuplate 34
- 4. Determinarea tensiunii superficiale prin metoda măsurării presiunii maxime
- de formare a unei bule de gaz în interiorul lichidului 42
- 5. Demonstrarea experimentală a entropiei 47
- 6. Determinarea presiunii de vapori şi a entalpiei de vaporizare prin metoda dinamică 49
- 7. Mărimi parţial molare. Determinarea experimentală a volumelor parţial molare 55
Extras din curs
1. LUCRĂRI PRACTICE DE CALORIMETRIE
1.1. DETERMINAREA CALORIMETRICĂ A ENTALPIEI DE
VAPORIZARE A LICHIDELOR
1. Scopul lucrării
Determinarea experimentală a entalpiei de vaporizare a acetonei prin metoda calorimetrică.
2. Teoria lucrării
Vaporizarea unui lichid este însoţită de absorbţie de căldură. Deoarece temperatura rămâne constantă, această energie absorbită serveşte pentru învingerea forţelor de atracţie intermoleculare şi la efectuarea lucrului de destindere a vaporilor împotriva presiunii atmosferice.
Cantitatea de căldură absorbită la vaporizarea izotermă a unui lichid aflat în echilibru cu vaporii săi se numeşte căldura (latentă) de vaporizare sau variaţia de entalpie de vaporizare. În funcţie de cantitatea de lichid vaporizată se definesc: căldura molară de vaporizare (Lv = Hvap ) cantitatea de căldură necesară pentru vaporizarea unui mol de lichid şi căldura specifică de vaporizare (lv = h) căldura necesară pentru vaporizarea unui gram de lichid la o anumită temperatură de lucru.
Legătura dintre căldura molară de vaporizare şi căldura specifică de vaporizare este dată de relaţia:
unde: M = masa molară
Entalpia de vaporizare scade cu creşterea temperaturii şi se anulează la temperatura critică. Entalpia de vaporizare se poate determina experimental prin două metode :
a) Din datele de echilibru lichid-vapori se determină presiunile de vapori saturanţi ale lichidului la două temperaturi diferite şi se aplică ecuaţia Clausius-Clapeyron :
Integrând între limitele p10, T1 şi p20, T2 se obţine :
(1)
sau
, (cal/mol)
Relaţia (l) se aplică atunci când presiunile de vapori sunt destul de mici pentru ca să se admită aplicabilitatea legii gazului perfect, iar cele două temperaturi destul de apropiate pentru ca să se poată neglija variaţia entalpiei de vaporizare cu temperatura.
b) Metoda calorimetrică permite determinarea directă a variaţiei de entalpie la vaporizarea lichidului.
3. Principiul metodei calorimetrice
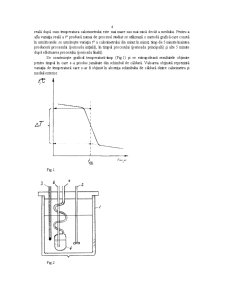
Într-un calorimetru se evapora o cantitate cunoscută de lichid, se măsoară scăderea temperaturii şi se calculează cantitatea de căldură neecesară pentru evaporarea lichidului. Raportul dintre cantitatea de căldură necesară pentru evaporarea lichidului şi cantitatea de lichid reprezintă căldura specifică de vaporizare.
Să presupunem că în calorimetru am introdus m grame de apă cu căldura specifică cp (cp = 1 cal/gK) şi în calorimetru am produs un proces care a pus în libertate cantitatea de căldură Q, temperatura apei din calorimetru crescând de la t1 la t2. Cantitatea de căldură degajată în timpul procesului se poate calcula cu relaţia:
(2)
Cantitatea de căldură Q astfel determinată nu este exactă deoarece în calorimetru mai au loc fenomene secundare care influenţează asupra valorii ei:
a) In vasul calorimetric pe lângă apă se mai găsesc un agitator, un termometru şi eventual alte dispozitive care împreună cu pereţii vasului calorimetric preiau o parte din căldura degajată în timpul procesului studiat. Din această cauză, temperatura finală a apei din calorimetru pe care o înregistrăm experimental este mai mică decât în realitate. Pentru a elimina această eroare ecuaţia (2) trebuie corectată astfel :
(3)
unde: m1, m2 … - masele pieselor calorimetrului;
c1, c2 … - căldurile specifice ale anexelor calorimetrului.
Suma m1c1 + m2c2 + … = K este cantitatea de căldură necesară pentru a încălzi cu 1°C piesele componente ale calorimetrului. Pentru aceeaşi cantitate de apă mărimea K are o valoare constantă numită echivalentul în apă al calorimetrului sau constanta calorimetrului. Această mărime se poate calcula în principiu cu relaţia:
K = m1c1+ m2c2 + …
dar în practică se determină producând în calorimetru un proces care pune în libertate o cantitate cunoscută de căldură. Relaţia (3) devine:
Preview document
Conținut arhivă zip
- Termodinamica.doc