Extras din curs
Abaterea de la gazul ideal. Ecuatii de stare
Ecuatia termica de stare pv = RT a gazului ideal a fost dedusa pentral gaz ipotetic, caruia i s-au atribuit anumite proprietati moleculare.
Deoarece gazele reale au, din punct de vedere molecular, o alta comportare (proprietati diferite), nu vor putea satisface ecuatia de stare a gazului ideal decat cu aproximatii sau erori si intr-un interval restrans de presiuni si temperaturi.
Adoptand drept criteriu de comparatie produsul pv, care la gazul ideal depinde numai de temperatura, experienta a dovedit ca, la temperatura constanta acest produs variaza in functie de presiune.
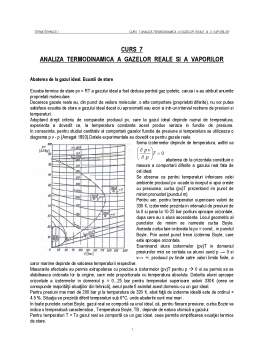
In consecinta, pentru studiul cantitativ al comportarii gazelor functie de presiune si temperatura se utilizeaza o diagrama p v - p (Amagat 1893).Datele experimentale au dovedit ca pentru gazele reale
forma izotermelor depinde de temperatura, astfel ca abaterea de la orizontala constituie o masura a comportarii diferite a gazului real fata de cel ideal.
Se observa ca pentru temperaturi inferioare celei ambiente produsul pv -scade la inceput si apoi creste cu presiunea, curba (pv)T prezentand im punct de minim pronuntat (punctul m)
Pentru aer, pentru temperaturi superioare valorii de 330 K, izotermele prezinta in intervalul de presiuni de la 0 si pana la 10-25 bar portiuni aproape orizontale, dupa care au o alura ascendenta. Locul geometric al punctelor de minim se numeste curba Boyle. Aceasta curba taie ordonata la pv = const., in punctul Boyle. Prin acest punct trece izoterma Boyle, care este aproape orizontala.
Examinand alura izotermelor (pv)T in domeniul presiunilor mici se contata ca atunci cand p → 0 si v→ ∞, produsul pv tinde catre valori limita finite, a caror marime depinde de valoarea temperaturii respective.
Masurarile efectuate au permis extrapolarea cu precizie a izotermelor (pv)T pentru p 0 si au permis sa se stabileasca ordonata lor la origine, care este proportionala cu temperatura absoluta. Datorita alurei aproape orizontale a izotermelor in domeniul p = 0...25 bar pentru temperaturi superioare valorii 330K (ceea ce corespunde majorităţii situaţiilor din tehnică), aerul poate fi asimilat acest domeniu cu un gaz ideal.
Pentru presiuni mai mari de 200 bar şi la temperatura de 320 K, abat faţă de izoterma ideală este de ordinul + 4.5 %. Situaţia se prezintă diferit temperaturi sub 0°C, unde abaterile sunt mai mari .
In toate punctele curbei Boyle, gazul real se comportă ca unul ideal, că, pentru fiecare presiune, curba Bozie va indica o temperatură caracteristica , Temperatura Boyle, TB , depinde de natura chimică a gazului
Pentru temperaturi T > Ts gazul real se comportă ca un gaz ideal, ceea permite simplificarea ecuaţiei termice de stare.
O metodă simplă este utilizarea ecuaţiei termice de stare corectată sub forma:
Pentru exprimarea proprietăţilor gazelor- reale sub forma unor ecuaţii carcteristice de stare s-au făcut numeroase propuneri (există peste 150 de ecuaţii de stare, bazate pe ipoteze simplificatoare sau pur empirice). Dintre acestea, unele referă la starea gazoasă, pe când altele implică ambele faze: lichidă şi gazoasă.
Un rol istoric în Termodinamică îl joacă ecuaţia Van der Waals ;Această ecuaţie termică de stare este bazată pe teoria cinetico-moleculară aplicata la gaze reale.
Van der Waals a imaginat un model de gaz ale cărui molecule sunt sfere perfect elastice animate de mişcarea termică şi aflate sub efectul acţiunii reciproce între molecule, el a separat efectul presiunii unui gaz real într-o parte datorita mişcării termice, pe care a denumit-o presiune termică p şi o altă parte, datorita acţiunii forţelor de coeziune între molecule, numită presiune internă (sau de coeziune) pi.
Presiunea termică a gazului este datorată impulsului primit de unitatea de
suprafaţă sub efectul acţiunii moleculelor şi se exprimă ca şi la gazul ideal:
unde R este constanta gazului real, iar F volumul corespunzător mişcarea termică.
Deoarece în momentul ciocnirii moleculele pot fi orientate oricum în spatiu se poate imagina o sferă de acoperire în momentul ciocnirii, având un diametru egal cu de două ori diametrul unei molecule, în cuprinsul căreia nu mai pătrunde centrul altei molecule. Această sferă a fost denumită covolumul moleculei, care pentru fiecare moleculă este împătritul volumului propriu. Notand cu b covolumul tuturor moleculelor pe unitatea de masă, rezultă: V*=V - mb
Cu aceasta, expresia presiunii termice devine:
unde v este volumul specific al gazului real. Din relaţie se vede că presiunea termică a gazului real este mai mare decât cea a unui gaz ideal.
Drept urmare, la un gaz real, manometrul va înregistra o presiune mai mică decât cea care corespunde mişcării termice a moleculelor: P = Pt - Pi
Pentru evaluarea termenului pi, Van der Waals a admis pe de o parte că forţa de coeziune este proporţională cu numărul de molecule, adică cu densitatea gazului, iar pe de altă parte efectul ei asupra presiunii este invers proporţională cu volumul, astfel că pentru m =l kg:
unde este un factor de proporţionalitate.
Aceasta este ecuaţia lui Van der Waals pentru gaze reale. Ea cuprinde trei coeficienţi numerici: a, b, R'.
Aplicând relatia pentru gaze în stare mult rarefiată, ecuaţia Van der Waals trebuie să treacă în ecuaţia caracteristică gazului ideal.
Preview document
Conținut arhivă zip
- Curs 7 - Analiza Termodinamica a Gazelor Reale si a Vaporilor.doc