Extras din curs
În cercetarea alimentelor la temperatura între –60C şi 300C multe efecte pot fi observate în timpul procesului de depozitare, de păstrare de stocare. Aceste fenomene pot fi endoterme (ca topirea, denaturizarea, gelatinizarea, evaporarea) sau procese exoterme (ca îngheţarea, cristalizarea şi oxidarea). Prin cunoaşterea precisă acestor faze de tranziţie, a condiţiilor optime pentru stocarea sigură sau tratarea alimentelor poate fi definite (Raemy) şi operaţiunile cele mai importante (Lambelet, 1991). Forţa operaţiilor a intreprinderii privind interesul pentru tehnicianul şi ingineri a produselor alimentare sunt date în tabelul 2.1.
Cap I.Fizica fazei de tranziţie
A.Curbe de răcire şi curbe de încălzire.
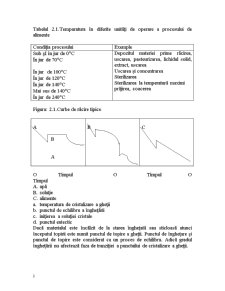
Curbe de răcire în timpul îngheţării sunt arătate în fig 2.1.
Ridicarea bruscă în temperatură venită datorită eliberării a căldurii şi a fuziunii după o iniţială superrăcire reprezintă începutul cristalizării gheţii.
Apa pură poate fi subrăcit cu mai multe grade înaintea a fenomenului de organizare a atomului. Odată ce masa critică a sistemului este atinsă, sistemul se organizează în punctul “a” în fig 2.1.şi îsi eliberează căldura latentă mai repedă decât căldura cu care căldura a fost înlăturată din sistem.Apoi temperatura se ridică instantaneu pînă la temperatura iniţială dela punctul “b”.
În soluţiile apoase în punctul “a” nu sunt aşa de mici ca apa pură deoarece soluţia adaugată va rezulta un nucleu heterogen asfel accelerănd procesul nucleatizării. Soluţia degradează foarte mult cantitatea răciri din cauza motivelor următoare: nucleaţie mai rapidă şi punctul de îngheţare mai scăzută.
În soluţii foarte concentrate este foarte dificil inducerea suprarăcirii.
După ce cristalizarea este terminată, temperatura scade deoarece o cantitate de căldură apreciabilă este eliberată în cazul apei în cazul soluţiei suprasaturaţia continuă datorită îngheţării apei şi soluţia cristalină se poate forma cu eliberarea latentă de călduă a soluţiei cristaline, cauzând o ridicarea atenuată a temperaturii de la punctul “c” la punctul “d”. Aceste puncte sunt cunoscuţi ca puncte entectice.
În cazul soluţiei cu substanţe dizolvate multiple sau alimente este greu de determinat punctele entectice. Din această cauză pot fi aşteptate multe puncte entectice diferite, dar fiecare platou destul de scurtă cantităţile mici de substanţe dizolvate au fost folosite.
Tabelul 2.1.Temparatura în diferite unităţi de operare a procesului de alimente
Condiţia procesului Exemple
Sub şI în jur de 0C
În jur de 70C
În jur de 100C
În jur de 120C
În jur de 140C
Mai sus de 140C
În jur de 240C Depozitul materiei prime răcirea, uscarea, pasteurizarea, lichidul solid, extract, uscarea
Uscarea şi concentrarea
Sterilizarea
Sterilizarea la temperatură maximi
prăjirea, coacerea
Figura: 2.1.Curbe de răcire tipice
O Timpul O Timpul O Timpul
A. apă
B. soluţie
C. alimente
a. temperatura de cristalizare a gheţii
b. punctul de echilibru a îngheţării
c. iniţierea a soluţiei cristale
d. punctul entectic
Dacă materialul este încălzit de la starea îngheţată sau sticloasă atunci începutul topirii este numit punctul de topire a gheţii. Punctul de îngheţare şi punctul de topire este considerat ca un proces de echilibru. Adică gradul îngheţării nu afectează faza de tranziţiei a punctuilui de cristalizare a gheţii.
Preview document
Conținut arhivă zip
- Gelatinizarea.DOC