Cuprins
- 1. Introducere.3
- 2. Date termodinamice necesare studiului.4
- 3. Transformarea temperaturilor de tranziţie de fază (de topire, de fierbere) ale substanţelor principale din procesul studiat în toate scările termodinamice.4
- 4. Aprecieri asupra stabilităţii compuşilor principali în comparaţie cu alţi compuşi ai aceluiaşi element.5
- 5. Calcularea entalpiei standard de reacţie.6
- 6. Calcularea entropiei standard de reacţie.7
- 7. Aprecieri calitative asupra variaţiei entropiei de reacţie în condiţii standard.8
- 8. Calcularea energiei libere Gibbs în condiţii standard.8
- 9. Aprecieri asupra spontaneităţii reacţiei în sistem izolat/neizolat.9
- 10. Calculul afinităţii de reacţie în condiţii standard.10
- 11. Determinarea entalpiei de reacţie în funcţie de temperatură. 10
- 12. Determinarea dependenţei entropiei de reacţie în funcţie de temperatură.12
- 13. Determinarea dependenţei energiei libere Gibbs în funcţie de temperatură.12
- 14. Particularizarea şi trasarea graficelor dependenţelor funcţiilor termodinamice pentru temperaturi de 300, 400, 800, şi 1500 K.13
- 15. Determinarea constantelor de echilibru în condiţii standard : Kx, Kc, Kp. 20
- 16. Concluzii. 21
- 17. Bibliografie.22
Extras din proiect
1. Introducere
Chimia fizică reprezintă ştiinţa care aplică legile fizicii în studiul sistemelor şi fenomenelor fizico-chimice, utilizând un aparat matematic dezvoltat; are rol de generalizare şi ordonare a cunoştiinţelor acumulate calitativ în Chimia Organică, Chimia Anorganică şi Chimia Macromoleculară.
Termodinamica chimică este o ramură a Chimiei Fizice, care se ocupă cu caracterizarea, din punct de vedere energetic, a proceselor fizico-chimice a sistemelor, cu determinarea probabilităţii de reacţie a substanţelor, a constantelor de material şi stabileşte metodele de determinare a caracteristicilor termice ale substanţelor.
În acest raport ştiinţific ne vom concentra asupra determinării unor mărimi energetice, potenţiale termodinamice, constante de echilibru, în scopul deducerii posibilităţilor de formare a unui anumit compus, în diverse situaţii.
Ecuaţia de reacţie propusă pentru realizarea studiului termodinamic în această lucrare este reacţia de oxidare a carbonului cu formare de dioxid de carbon:
C(s) + O2(g) ↔ CO2(g)
2. Date termodinamice necesare studiului
Tabelul 1.
Date termodinamice pentru C, O2, CO2 [1]
Nr.
crt.
Substanţa
∆H
S
C = f(t)
cal/mol∙K
kcal/mol cal/mol∙K a b∙10
c∙10
1. C 0 1,37 4,10 1,02 -2,10
2. O2 0 49,00 7,52 0,81 -0,90
3. CO2 -94,05 51,06 10,55 2,16 -2,04
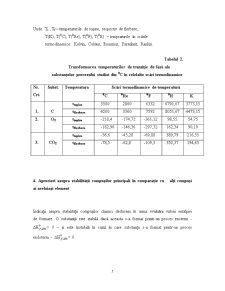
3. Transformarea temperaturilor de tranziţie de fază (de topire, de
fierbere) ale substanţelor principale din procesul studiat în toate
scările termodinamice
La transformarea unei temperaturi dintr-o scară în alta trebuie să se ţină cont de corelaţia valorilor unui grad în cele două scări, dar şi de translaţia axelor. Corelaţia dintre grade este următoarea:
10C = 1K = 0Re = 0F = 0R.
Ţinând cont de translaţia de axe, putem scrie:
T(K) = T(0C) + 273,15 (1)
T(0Re) = T(0C) (2)
T(0F) = T(0C) + 32 (3)
T(0R) = T(0C) + 491,67 (4)
Unde: Tt , Tf – temperaturile de topire, respectiv de fierbere;
T(K), T(0C), T(0Re), T(0F), T(0R) – tempraturile în scările
termodinamice: Kelvin, Celsius, Reaumur, Farenheit, Rankin.
Preview document
Conținut arhivă zip
- Calculul Termodinamic al Reactiei de Oxidare a Carbonului.doc