Cuprins
- pag.
- I. Notiuni introductive 3
- -date necesare studiului termodinamic 4
- II. Transformarea temperaturii de topire si de firbere in toate scarile termodinamice 5
- III. Entalpia
- 1.Calcul in conditii standard 6
- 2.Aprecieri asupra stabilitatii compusilor obtinuti in comparatie cu alti compusi similari 6
- 3.Determinarea dependentei entalpiei de reactie in functie de temparatura 7
- 4.Particularizarea si trasarea grafica a dependentei entalpiei la 370K, 570K, 770K si 1000K pentru un mol de substanta principala respenctiv 200kg de substanta principala 8
- IV. Entropia
- 1.Calcul in conditii standard 10
- 2. Aprecieri calitative asupra variaţiei entropiei de reacţie în condiţii standard 11
- 3.Determinarea dependentei entropiei de reactie in functie de temparatura 11
- 4.Particularizarea si trasarea grafica a dependentei entropiei la 370K, 570K, 770K si 1000K pentru un mol de substanta principala respenctiv 200kg de substanta principala 11
- V. Energia libera Gibbs
- 1.Calcul in conditii standard 13
- 2.Aprecieri asupra spontaneitatii procesului sistemului izolat/neizolat 14
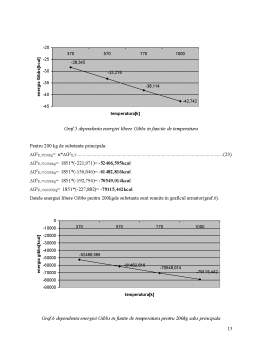
- 3.Particularizarea si trasarea grafica a dependentei energiei libere Gibbs la 370K, 570K, 770K si 1000K pentru un mol de substanta principala respenctiv 200kg de substanta principala 14
- VI. Afinitatea
- -calculul afinitatii in conditii standard 16
- VII. Concluzii 17
- VIII. Bibliografie 18
Extras din proiect
I. Notiuni introductive
Clasificarea fenomenelor fizice si chimice are doar importanta didactica, deoarece in realitate fenomenele naturale sau cele prelevate implica totdeauna concomitent modificarile fizice si chimice ale sistemului. „Chimia fizica” a aparut astfel din necesitatea studierii fenomenelor complexe, vizand in special domeniul de jonctiune intre fizica si chimie.
Chimia fizica are ca obiect aplicarea cunostintelor si metodelor experimentale si teoretice din fizica la studiul fenomenelor si substantelor chimice
Cuprinde trei domenii mari:structura materialelor, termodinamica si cinetica
Termodinamica este o stiinta complexa care include pe langa notiunile de termodinamica clasica si notiuni de mecanica statistica si termodinamica moleculara.
Studiul termodinamic al reactiei de reducere a oxidului de argint implica ca reactanti substanta oxid de argint (Ag2O) si elementul chimic Carbon (C), iar ca produsi argintul (Ag) si monoxidul de carbon (CO).
Argintul este un metal alb stralucitor, si dupa cum ii spune numele argintiu. In taietura proaspata, are o culoare usor galbuie. Face parte impreuna cu aurul, platina, paladiu, iridiu din categoria metalelor pretioase. Este moale, maleabil si ductil, fiind metalul cu cea mai mare conductibilitate electrica si termica. Se oxideaza cu usurinta in aer, formand oxizi(ex: Ag2O) si, de asemenea, in prezenta sulfului, cu care formeaza sulfuri.
Monoxidul de carbon este o combintie între un atom de carbon si un atom de oxigen. El este un gaz asfixiant, toxic, incolor şi inodor, care ia nastere printr-o ardere (oxidare) incompleta a substantelor care contin carbon. Acest proces are loc în cazul arderii la temperaturi inalte într-un loc sarac în oxigen, formandu-se monoxidul în locul bioxidului de carbon. Monoxidul este un gaz inflamabil, care arde cu o flacara albastra.
Carbonul este un element remarcabil din mai multe motive. Printre formele sale diferite se numara una dintre cele mai moi (grafit) şi una dintre cele mai dure (diamant) dintre substantele cunoscute. Numele sau vine din frantuzescul charbone, care, la randul sau, vine din latinescul carbo, însemnand carbune.
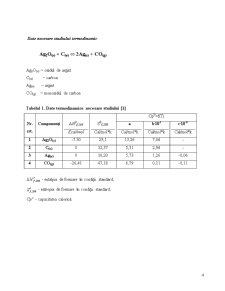
Date necesare studiului termodinamic
Ag2O(s) + C(α) 2Ag(s) + CO(g)
Ag2O(s) − oxidul de argint
C(α) − carbon
Ag(s) − argint
CO(g) − monoxidul de carbon
Tabelul 1. Date termodinamice necesare studiului [1]
Nr. crt.
Componenţi
∆H0f,298
Kcal/mol
S0f,298
Cal/mol*k Cp0=f(T)
a
Cal/mol*k b∙103
Cal/mol*k c∙10-5
Cal/mol*k
1 Ag2O(s) -7.30 29,1 13.26 7,04 -
2 C(α) 0 12,37 5,31 2,94 -
3 Ag(s) 0 10,20 5,73 1,26 -0,06
4 CO(g) -26,41 47,18 6,79 0,11 -0,11
- entalpia de formare în condiţii standard;
- entropia de formare în condiţii standard;
- capacitatea calorică.
II. Transformarea temperaturii de topire si de fierbere in toate scarile termodinamice
T(K) = T(oC) + 273,15……………………………………………………………………………(1)
T(oF) = ∙ T(oC) + 32…………………………………………………………………………….(2)
T(oR) = ∙ T(oC) + 491,67…………………………………………………………………….....(3)
T(oRe) = ∙ T(oC) + 0…………………………………………………….……………….……..(4)
Preview document
Conținut arhivă zip
- Studiul Termodinamic al Reactiei de Reducere a Oxidului de Argint.doc