Extras din proiect
I. Noţiuni intoductive
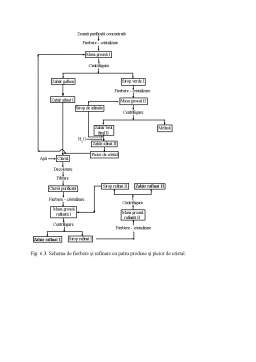
Cristalizarea reprezintă procesul de separare a fazei solide, din topituri sau din soluţie.
În practica analitică se foloseşte frecvent recristalizarea, care este o operaţie de cristalizare repetată, ce constă din dizolvarea substanţei cristaline într-un solvent adecvat, purificarea soluţiei şi separarea din nou a substanţei cristaline din soluţie, prin răcire, concentrare sau altă metodă. Substanţa solidă cristalină se separă din soluţia mamă prin filtrare, urmată de spălare, în acest fel fiind îndepărtate impurităţile, care rămân în soluţie. Puritatea sub-stanţei solide separată prin cristalizări repetate se determină prin efectuarea punctului de topire. Recristalizarea permite purificarea substanţelor aflate în cantitate mică şi cu puncte de topire apropiate.
Cristalul solid prezintă o anumită structură internă; el este omogen din punct de vedere chimic, de formă regulată. Atomii, ionii şi moleculele din structura cristalelor ocupă poziţii simetrice într-o reţea spaţială. O substanţă solidă cristalină poate cristaliza în diferite modificaţii, care sunt stabile într-un anumit interval de presiune şi temperatură.
Pentru ca o substanţă să cristalizeze este necesar ca soluţia să fie supra-saturată şi să apară în aceasta centre (nuclee, germene) de cristalizare, prin a căror creştere se formează cristalele de mărime adecvată. Centrele de cristalizare încep să se formeze dacă se răceşte soluţia unei substanţe solide la o temperatură mai scăzută decât cea corespunzătoare saturaţiei. Formarea centrelor de cristalizare depinde de gradul de subrăcire a soluţiei, viteza de răcire, modul de agitare a soluţiei, nivelul temperaturii, caracteristicile substanţei dizolvate, natura impurităţilor conţinute. Pentru substanţe dizolvate cu mase molare scăzute, realizarea unei răciri rapide printr-o agitare energică, conduce la formarea unui număr mare de centre de cristalizare. Numărul de centre de cristalizare apărute determină forma şi mărimea cristalelor: un număr mic de centre favorizează formarea de cristale mari, care cresc lent şi au suprafaţa bine dezvoltată, pe când un număr mare conduce la obţinerea unui precipitat microcristalin, cu cristale puţin dezvoltate. Pentru ca centrele microcristaline să devină cristale vizibile, trebuie să se producă agitarea soluţiei, care conduce la menţinerea stării de suprasaturare în zona adiacentă cristalelor.
Viteza de cristalizare şi de creştere a cristalelor depind de simetria mole-culelor: substanţele cu molecula simetrică cristalizează mai repede decât cele cu moleculă nesimetrică, aşa cum este cazul pdiclor benzenului, care are o viteză de cristalizare de 25 m/s, faţă de 2,2 în cazul odiclorbenzenului, respectiv 0,7 pentru mdiclor benzen. Impurităţile prezente în soluţie încetinesc procesul de cristalizare: ele se adsorb la suprafaţa cristalelor, inhi-bând creşterea lor.
Pentru realizarea unei cristalizări eficiente, o deosebită importanţă trebuie acordată alegerii dizolvantului (solventului) care solubilizează substanţa solidă cristalină. Aplicând dictonul latin Similia similibus solvuntur se vor alege sol-venţi care să prezinte structură chimică asemănătoare cu cea a substanţei care trebuie să se dizolve. În acest sens există o serie de solvenţi care începe cu eterul de petrol şi se termină cu apa, aşezaţi în ordinea scăderii caracterului lor hidrofob; solvenţii cu cel mai larg domeniu de solubilitate faţă de substanţele organice se situează la mijlocul acestei serii. Într-o clasă de solvenţi cu caracter chimic asemănător (ex. alcolii), cei care au temperaturi de fierbere mai ridicate, prezintă o capacitate de dizolvare mai mare. Cele mai cunoscute substanţe organice folosite ca solvenţi sunt hidrocarburile, individuale sau amestecuri ale acestora, derivaţii halogenaţi, esterii, eterii, cetonele, alcoolii, acizii organici, etc. Când pentru dizolvare se utilizează un amestec de hidro-carburi (fracţiuni petroliere) se va avea grijă să nu folosească fracţiuni cu interval de distilare mai mare de 30oC, din cauza diferenţei în ceea ce priveşte puterea (capacitatea) de dizolvare manifestată de diversii componenţi ai sol-ventului (mai redusă pentru termenii inferiori, cu temperatură de fierbere mai coborâtă). Dintre dizolvanţii anorganici, cel mai cunoscut este apa, care prezintă o bună capacitate de dizolvare pentru multe substanţe: alcooli, fenoli, zaharuri etc. La dizolvarea unei substanţe cristaline într-un anumit solvent trebuie avut în vedere faptul că majoritatea dizolvanţilor nu sunt absolut inerţi chimic faţă de substanţa dizolvată, producându-se reacţie chimică între aceş-tia, într-o măsură mai mare sau mai mică. O mare atenţie se va acorda purităţii solvenţilor, folosindu-se numai solvenţi de înaltă puritate.
Nu sunt indicaţi a se folosi pentru dizolvarea substanţelor solide cristaline acei solvenţi care dizolvă uşor substanţa chiar la rece, dar nici cei care nu realizează dizolvarea nici la fierbere, chiar dacă este folosit în exces mare.
În cazul dizolvării substanţelor solide care conţin o proporţie mare de im-purităţi, se recomandă înlăturarea acestora, printr-o metodă eficace, înaintea realizării dizolvării. Pentru a realiza o dizolvare rapidă se recomandă mă-runţirea substanţei solide cristaline, prin mojarare. Se prepară de regulă soluţii puţin mai diluate, cu concentraţie sub limita de saturaţie, pentru că o soluţie saturată la cald cristalizează spontan la răcire, creând astfel dificultăţi la filtrare, când se înfundă materialul de filtrare.
Cristalizarea prin răcirea soluţiei este procedeul cel mai des folosit; răcirea se conduce de aşa manieră încât să ducă la formarea de cristale cu dimensiu-ni medii. Temperatura la care se formează numărul maxim de centre de cristalizare nu este identică cu temperatura la care viteza de creştere a cris-talelor este maximă: în general, temperatura la care se formează numărul maxim de centre de cristalizare este cu cca 90oC inferioară temperaturii de topire a substanţei, în timp ce temperatura creşterii optime a cristalelor este mult mai ridicată, rămânând, evident, inferioară temperaturii de topire a sub-stanţei cristaline.
Cristalizarea poate fi provocată şi prin însămânţare, când se introduc în soluţie câteva cristale de substanţă (amorsă).
Separarea cristalelor din soluţia mamă se realizează prin filtrare, de regulă în vacuum. Spălarea cristalelor de pe materialul filtrant se realizează cu porţiuni mici de solvent, evitând folosirea unui exces prea mare de solvent care ar dizolva substanţa.
O altă metodă de cristalizare a substanţelor din soluţie este cea realizată prin concentrarea soluţiilor; astfel de procedee se folosesc în cazul soluţiilor obţinute prin dizolvarea solidelor cristaline în dizolvanţi volatili (cu temperatură de fierbere coborâtă). În acest caz soluţia se prepară la cald, iar concentrarea ei se realizează prin evaporarea solventului.
Cristalizarea fracţionată este o metoda de separare. Pentru o înţelegere mai bună a procesului prezentăm câteva noţiuni generale despre soluţii şi dizolvare.
O soluţie este un amestec omogen de două sau mai multe componente. La o soluţie se disting două componente: solventul - substanţa care dizolvă şi dizolvatul-substanţa dizolvată. Dizolvarea este un proces fizico-chimic care decurge în două etape: în prima etapă se desfac legăturile din interiorul moleculelor de dizolvat, iar în a doua etapă are loc o răspândire a lor printre moleculele dizolvantului, care se orientează în funcţie de polaritate în jurul moleculelor de dizolvat, luând naştere noi legături solvent-solvat.
Deoarece in prima etapă se desfac legături chimice puternice, acest proces are loc cu absorbţie de căldură, deci este endoterm, iar în cea de-a doua etapă se formează legături noi mai slabe şi are loc o degajare de căldură, acest proces fiind exoterm. În concluzie, în ansamblu dizolvarea poate avea loc cu variaţie de temperatură sau să nu fie însoţită de variaţie termică.
Preview document
Conținut arhivă zip
- Cristalizarea.doc