Cuprins
- 1. Deferizarea apei minerale naturale folosind oxigenul ca agent de oxidare 3
- 2. Schema tehnologica de deferizare a apei minerale naturale 4
- 3. Modelarea matematică a procesului de deferizare al apei minerale naturale 5
- 4. Implementarea programului Stimela în modelarea matematică a procesului de deferizare al apei minerale 16
- 5. Studiu de caz: Izvorul Principal – Borsec 18
- 6. Bibliografie 21
Extras din proiect
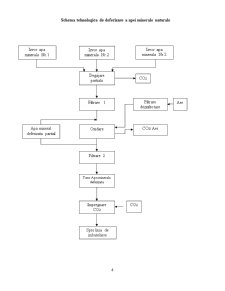
Apa minerală este colectată de la trei izvoare:
1. degajarea parţială este prima operaţie din procesul de deferizare al apei minerale naturale, operaţie în care se reduce concentraţia bioxidului de carbon
2. degajare parţială se realizează în recipiente închise pentru a nu permite contactul apei cu minerale cu aerul atmosferic.
Apă minerală degajată parţial cu o concentraţie scăzută a dioxidului de carbon, părăseşte tancul de degajare şi intră în filtrul celular cu diametrul porilor de 100 μm.
3. degajare şi filtrare tehnologia de deferizare a apelor minerale cuprinde:
- Oxidare pentru dizolvarea în apă a oxigenului strict necesar transformării fierului divalent în fier trivalent,
- Un volum de contact pentru asigurarea timpului cerut de reacţiile chimice de oxidare a 50 60% din fierul divalent
- Filtrarea prin nisip într-o singură treaptă în care se continua oxidarea până la 100 % şi se reţine fierul trivalent.
Oxidarea trebuie să fie realizată astfel încât să se asigure cantitatea de oxigen strict necesară, care se poate calcula steociometric din relaţia:
2Fe (OH)2 + O + H2O – 2Fe (OH)3
Ceea ce conduce la 1 mg/dm³ de oxigen pentru fiecare 7 mg/dm³ fier divalent.
Procesul tehnologic urmăreşte să elimine pierderile posibile de dioxid de carbon şi să evite contactul cu aerul atmosferic.
Oxidarea se realizează prin insuflare de aer, într-un recipient oxidator închis în care se pulverizează apă ce urmează să fie oxidata.
La prima treaptă de filtrare se va folosi nisip cu granulaţia cuprinsă între 1 şi 2,5mm, iar la a doua treaptă, de filtrare între 0,6 şi 1,2mm. Vitezele de filtrare ar putea fi diferite la cele două trepte de filtrare, dar din motive practice se folosesc recipiente de filtrare de acelaşi dimensiuni şi ca atare rezulta viteze egale, care se aleg între 6 şi 8m/h.
Schema tehnologica de deferizare a apei minerale naturale
Modelarea matematică a procesului de deferizare al apei minerale naturale
Teoria îndepărtării fierului
În apă fierul există sub două forme diferite:
- fierul feros – fierul II (Fe²+)
- fieru feric – fierul III (Fe3+)
Fierul feros se transformă în fier feric prin oxidare.
Agentul de oxidare folosit în cazul tratamentului apei minerale naturale este oxigenul.
Produsul de solubilitate al hidroxidului de fier (III) la 25ºC este 2,0 - 10-39.
Procesele de îndepărtare a fierului în filtre
Metoda cea mai utilizată pentru îndepărtarea fierului din apă minerală naturală este aerarea, urmată de filtrarea rapidă cu nisip.
Există câteva mecanisme de îndepărtare a fierului care contribuie la îndepărtarea fierului în filtre:
- filtrarea flacoanelor
- îndepărtarea fierului absorbit.
Oxidarea şi formarea flacoanelor
Procesul de absorbţie – oxidare
Fe2+
O2 Fe3+
Hidroliza Formare flacoane
Filtrare
Oxidarea şi hidroliza Fierului
Transformarea fierului are loc prin intermediul a două procese: oxidarea şi hidroliza în prezenţa O2, Fe (II) va fi oxidat de Fe (III). Datorită solubilităţii scăzute a hidroxilului de Fe (III), acesta va hidroliza rapid pentru a forma flacoane de hidroxid de fier Fe (III)
Reacţia de oxidare, şi reacţia de hidroliza
4Fe2+ + O2 + 2H2O ↔ 4Fe3+ + 4OH-
4Fe3+ + 4OH- + (2x + 2) H2O ↔ 2(Fe2O3 - xH2O) + 8H+
Ecuaţia reacţiei generale devine:
4Fe2+ + O2 + (2x + 4) H2O ↔ 2(Fe2O3 - xH2O) + 8H+
Echilibru de oxidare al fierului poate fi dedus din ecuaţia lui Nerst pentru sistemul Fe2+/Fe3+ E (1) şi oxigen/apa E (2).
Ecuatia lui Nerst:
RT Ox
E = E0 + log
nF Re d
in care:
Eo- potential redox, [ mV ]
R- constanta universala a gazelor, 8,314570 J/Kmol;
T- temperatura absoluta, [K];
n- numarul de electroni;
f- constanta Faraday, 9648,6C/mol;
E(1)- echilibrul de oxidare pentru sistemul Fe²+/Fe3+
E(1)- echilibrul oxigen/apa.
Preview document
Conținut arhivă zip
- Deferizarea Apei Minerale Naturale Folosind Oxigenul ca Agent de Oxidare - Studiu de Caz Borsec - Izvorul Principal.doc