Cuprins
- - Introducere ..pag 3
- - Structura tabelului periodic ..pag 6
- - Corelația dintre structura învelișului de electroni și poziția elementelor în sistemul periodic ..pag 10
- - Variația proprietăților fizice și chimice ale elementelor în sistemul periodic ...pag 11
- - Bibliografie .. . ..pag 18
Extras din referat
IntroducereIntroducereIntroducereIntroducereIntroducereIntroducereIntroducereIntroducereIntroducereIntroducereIntroducere
Odată cu precizarea noțiunii de element chimic (Lavoisier, sec. XVIII) și cu descoperirea de noi elemente, încă de la începutul secolului XIX s-a impus, ca o necesitate obiectivă, problema clasificării elementelor pe baza unor criterii științifice.
Dintre toate încercările de clasificare cu care se confruntă chimia în jurul anilor 1860-1870, cea mai importantă aparține chimistului rus D. I. Mendeleev, descoperitorul legii periodicității: proprietățile chimice și fizice ale elementele se repetă periodic după anumite intervale în ordinea crescătoare a maselor lor atomice.
S-au impus două forme ale sistemului periodic: forma scurtă și forma lungă.
Tabelul periodic este, fără îndoială, cel mai important concept din chimie, atât în principiu, cât și în practică. Este sprijinul de zi cu zi pentru studenți, sugerează noi căi de cercetare pentru profesioniști, și oferă o organizare succintă pentru întreaga chimie. Este o demonstrație remarcabilă a faptului că elementele chimice nu sunt un grup aleatoriu de entități, ci prezintă tendințe și se află împreună în familii. Conștientizarea mesei periodice este esențială pentru oricine dorește să descifreze lumea și să vadă cum este construită din blocurile fundamentale ale chimiei - elemente chimice.
Necesitatea clasificarii elementelor
Știm până acum că elementele sunt unitățile de bază ale tuturor tipuri de materie. În 1800, doar 31 de elemente erau cunoscute. Din 1865, numărul de elemente identificate a fost mai mare - dublat la 63. În prezent sunt cunoscute 114 elemente. Elementele recent descoperite sunt făcute de om. Eforturile de a sintetiza elemente noi continuă. Cu un număr atât de mare de elemente este foarte dificil de studiat individual, chimia tuturor acestor elemente și a lor numeroși compuși în mod individual. Pentru a ușura acest lucru, oamenii de știință au căutat o cale sistematică să-și organizeze cunoștințele prin clasificarea elementelor. Nu doar că ar raționaliza aspectele chimice cunoscute despre elemente, dar ar putea chiar și să prevada altele noi pentru a continua studiu.
Aparitia clasificarii periodice
Clasificarea elementelor în grupuri și dezvoltarea Tabelului periodic reprezintă consecințele sistematizării cunoștințelor dobândite de un număr de oameni de știință prin observațiile și experimentele lor. Chimistul german, Johann Dobereiner din Germania începutul anilor 1800 a fost primul care a luat în considerare ideea tendințelor dintre proprietățile elementelor. Din 1829 el a remarcat o asemănare între fizic și proprietățile chimice ale mai multor grupuri de trei elemente (triade). În fiecare caz, el a observat că elementul de mijloc al fiecăruia dintre ele, avea o greutate atomică cam la jumătate fata de greutățile atomice ale celorlalte două (Tabelul 2). De asemenea, proprietățile elementului din mijloc erau între cele ale celorlalți doi membri.
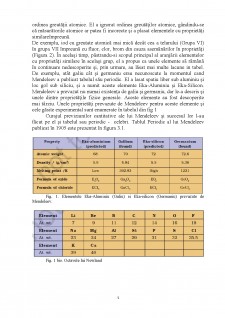
Din moment ce relația lui Dobereiner, numită Legea triadelor, părea să fie valabila doar pentru câteva elemente, a fost respinsă fiind considerata drept coincidență. Următoarea încercare inregistrată de clasificare a elementelor a fost făcută de un francez geolog, A.E.B. de Chancourtois în 1862. El aranjat apoi elementele cunoscute în ordinea cresterii greutatii atomice si a facut tabelul cilindric de elemente pentru a afișa recurența periodică a proprietăților. Nici acest lucru nu a atras prea multă atenție. Chimistul englez, John Alexander Newlands în 1865 aprofundează Legea Octavelor. El a aranjat elementele în ordinea crescătoare a greutăți atomului lor și a remarcat că fiecare al optulea element a avut proprietăți similare cu primul element (Tabelul 1 bis). Relația avea o similaritate intocmai ca a opta notă muzicala care seamănă cu prima în octava muzicala. Legea Octavelor a lui Newlands părea a fi valabila doar pentru elemente până la calciu. Deși ideea lui nu a fost acceptată pe scară largă in acel timp, el, pentru munca sa, a fost ulterior premiat cu Medalia Davy în 1887 de către Societatea Regală, Londra.
Legea periodică, așa cum o știm astăzi, se datorează dezvoltarii sale de către chimistul rus, Dmitri Mendeleev (1834-1907) și germanul chimist, Lothar Meyer (1830-1895). Lucrand în mod independent, ambii chimiști au propus în 1869 aranjarea elementelor în ordinea crescândă a greutăților lor atomice, aparand similitudini în proprietățile fizice și chimice la intervale regulate. Lothar Meyer a trasat proprietățile fizice, cum ar fi volumul atomic, punctul de topire și punctul de fierbere față de greutatea atomică și a obținut un model repetat periodic. Spre deosebire de Newlands, Lothar Meyer a observat o schimbare în lungimea modelului repetat. În 1868, Lothar Meyer a dezvoltat o masă a elementelor care seamănă foarte mult cu modelul tabelului periodic. Cu toate acestea, munca lui nu a fost publicata decat după lucrările lui Dmitri Mendeleev, omul de știință care este în general creditat cu dezvoltarea Tabelul Periodic Modern.
În timp ce Dobereiner a inițiat studiul relației periodice, Mendeleev a fost cel responsabil pentru publicarea Legii Periodice pentru prima dată. Acesta prevedeurmătoarele: ’’Proprietățile elementelor sunt a funcția periodică a atomului lor greutăți.” Mendeleev a aranjat intr-un tabel elementele în rânduri orizontale și coloane verticale în ordinea crescatoare a greutății lor atomice astfel incat elementele cu proprietăți similare au ocupat aceeași coloană verticala sau grup. Sistemul lui Mendeleev de clasificare a elementelor a fost mai elaborat decât cel al lui Lothar Meyer. El a recunoscut pe deplin semnificația periodicitatii și a folosit o gamă largă de proprietăți fizice și chimice pentru a clasifica elementele. Mendeleev s-a bazat în special pe asemănările din formulele empirice și proprietățile compușilor formați de elemente. El și-a dat seama că unele elemente nu se încadreaza în schema sa de clasificare dacă s-ar urma strict ordinea greutății atomice. El a ignorat ordinea greutăților atomice, gândindu-se
că măsurătorile atomice ar putea fi incorecte și a plasat elementele cu proprietăți
similareîmpreună.
Bibliografie
https://mail.uaic.ro/~marius.mihasan/teaching/pdfs/general_chemistry_courses/CURS%204.pdf
http://ncert.nic.in/
http://chim.upt.ro/_old/comunicate-cadre/57533Chimie_IE_Curs_3.pdf
http://elth.ucv.ro/fisiere/probleme%20studentesti/Cursuri/Chimie/Chimia%20tehnica%20suport%20curs.pdf
Preview document
Conținut arhivă zip
- Sistemul periodic al elemetelor.pdf