Cuprins
- 1. Generalităţi. Definirea metodei de analiză
- 2. Principiul metodei
- 3. Avantajele metodei
- 4. Dezavantajele metodei
- 5. Aparatura utilizată
- 6. Etapa preparativă de pregătire a probelor
- 7. Descrierea metodei de lucru
- 8. Rezultate furnizate
- 9. Interpretarea rezultatelor obţinute
- 10. Aplicaţii în identificarea componentelor alimentare
- Bibliografie
Extras din referat
1. Definirea metodei de analiză
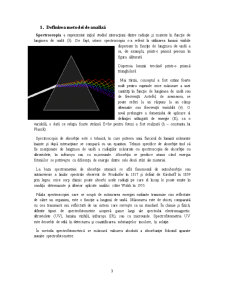
Spectroscopia a reprezentat iniţial studiul interacţiuni dintre radiaţie şi materie ȋn funcţie de lungimea de undă (λ). De fapt, istoric spectroscopia s-a referit la utilizarea luminii vizibile dispersate ȋn funcţie de lungimea de undă a sa, de examplu, printr-o prismă precum ȋn figura alăturată
Dispersia luminii trecând printr-o prismă triunghilară
Mai târziu, conceptul a fost extins foarte mult pentru cuprinde orice măsurare a unei cantităţi ȋn funcţie de lungimea de undă sau de frecvenţă. Astefel, de asemenea, se poate referi la un răspuns la un câmp alternativ sau frecvenţă variabilă (v). O nouă prelungire a domeniului de aplicare al definiţiei adăugată de energie (E), ca o variabilă, o dată ce relaţia foarte strânsă E=hv pentru fotoni a fost realizată (h – constanta lui Planck).
Spectroscopia de absorbţie este o tehnică, ȋn care puterea unui fascicul de lumină măsurate ȋnainte şi după interacţiune se compară cu un eşantion. Tehnici specifice de absorbţie tind să fie menţionate de lungimea de undă a radiaţiilor măsurate cu spectroscopia de absorbţie cu ultraviolete, ȋn infraroşu sau cu m,icrounde. Absorbţia se produce atunci când energia fotoniilor se potriveşte cu diferenţa de energie dintre cele două stări ale materiei.
La baza spectrometriei de absorbţie atomică se află fenomenul de autoabsorbţie sau autoinversie a liniilor spectrale observat de Frauhofer ȋn 1817 şi definit de Kirchoff ȋn 1859 prin legea: orice corp chimic poate absorbi acele radiaţii pe care el ȋnsuşi le poate emite ȋn condiţii determinate şi ulterior aplicate analitic către Walsh ȋn 1955.
Filiala spectroscopiei care se ocupă de măsurarea energiei radiante transmise sau reflectate de către un organism, este o funcţie a lungimii de undă. Măsurarea este de obicei, comparată cu cea transmisă sau reflectată de un sistem care serveşte ca un standard. Ȋn chimie şi fizică, diferite tipuri de spectrofotometrie acoperă game largi ale spectrului electromagnetic: ultraviolete (UV), lumina vizibilă, infraroşu (IR), sau cu microunde. Spectrofotometria UV este deosebit de utilă ȋn detectarea şi cuantificarea substanţelor incolore, ȋn soluţie.
Ȋn metoda spectrofotometrică se măsoară valoarea absolută a absorbanţei folosind aparate numite spectrofotometre.
2. Principiul metodei
Spectrofotometria de absorbţie atomică se bazează pe determinarea concentraţiei ununui element chimic din proba ce se analizează, prin măsurarea absorbţiei unei radiaţii electromagnetice cu lungime de undă specifică, la trecerea acesteia prin mediul ȋn care sunt uniform distribuiţi atomii liberi ai elementului respectiv. Nivelul de absorbţie este proporţional cu concentraţia atomilor ȋn mediul de distribuţie.
Dacă lumina doar a lungimii de undă inflenţează drumul liber, starea de bază a unui atom, atomul poate absorbi lumina şi intră ȋntr-o stare excitată ȋntr-un proces cunoscut sub denumirea de absorbţie atomică.
Absorbţia atomică măsoră cantitatea de lumină, la lungimea de undă de rezonanţă care este absorbită ȋn timp ce aceasta trece printr-un nor de atomi. Deoarece numărul de atomi ȋn calea luminii creşte, cantitatea de lumină absorbită creşte ȋntr-un mod previzibil. Prin măsurarea cantităţii de lumină absorbită, o determinare cantitativă a valorii elementului analit prezent poate fi făcută. Utlizarea surselor de lumină speciale, şi o selecţie atentă a lungimii de undă permite determinarea cantitativă a elementelor specifice individuale, ȋn prezenţa altora. Norul de atomi necesar pentru măsuratorile de absorbţie atomică este produs prin furnizarea de energie termică suficientă probei pentru a disocia compuşi chimici ȋn atomi liberi. Aspirând o soluţie de probă ȋntr-o flacără aliniată ȋn fascicolul luminos serveşte acest scop. Ȋn condiţiile flacării propriu-zise, cea mai mare parte din atomi vor rămâne ȋn forma stării de bază şi sunt capabili să absorbă lumina la lungimea de undă de anliză de la o lampă de sursă. Uşurinţa şi viteza cu care aceste determinări precise şi exacte pot fi realizate cu această tehnică, au făcut absorbţia atomică una dintre cele mai populare metode de determinare a metalelor.
Vom descrie mişcarea de obiecte microscopice cu ajutorul legii lui Newton. Putem cu uşurinţă măsura viteza, acceleraţia, forţa şi potenţialul energiilor, precum şi cuantifica efectele gravitaţionale. Cu toate acestea, atunci când ne uităm la particulele atomice (de exemplu protoni, electroni, neutroni), nu mai putem descrie mişcarea energia, utilizând fizica newtoienă. Caracteristicile particulelor atomice sunt descrise utilizând teoreme ale mecanici cuantice.
Mecanica cuantică – sau chimia cuantică- descrie geometria atomilor şi moleculelor, ȋn termeni ai expresiilor matematice complexe. De asemenea, descrie stările relativeale m,ateriei atomice. Spectrometria de absorbţie atomică utilizează principiile chimiei cuantice pentru a detecta prezenţa anumitor metale (aluminiu, fier, cupru), şi determină concentraţia acestor metale ȋn probe.
Toţi atomii şi componentele lor au energie. Nivelul de energie la care există un atom face referire la starea sa. Ȋn condiţii normale, atomii există ȋn cele mai stabile stări ale lor. Ne referim ȋn special la cel mai stabil nivel şi anume starea de bază. Chiar dacă noi nu putem măsura starea de energie precisă pentru un atom, putem măsura de obicei, modificări de la energia sa relativă la starea sa de bază. Anumite procese pot schimba starea de energie pentru un atom. De exemplu, adăugarea de energie termică (căldură poate provoca un atom să crească ȋntr-o stare mai mare de energie. Ne referim la stările de energie, care sunt mai mari decât stările de bază ca şi stările excitate. Ȋn teorie, există stări excitate infinite, cu toate acestea, există ȋn scădere numeroşi atomi dintr-o populaţie care ating stări excitate mai mari.
Legile mecanicii cuantice ne spun că atomii nu ȋşi măresc nivelurile lor de energie treptat. Un atom merge direct de la o stare la alta, fără a trece prin stări intermediare. Ne referim la aceste „salturi cuantice” ca tranziţii. Tranziţia de la starea de bază (notată cu E) la prima stare excitată (E1) impune o anumită formă de intrare de energie. Această energie este absorbită de către atom. Atunci când această aborbţie de energie are loc ȋn prezenţa luminii ultraviolete, o parte din acea lumină va fi absorbită. Această absorbţie UV are loc la o lungime de undă specifică.
Bibliografie
1. Banu C. (coord.), Calitatea şi controlul calităţii produselor alimentare, Ed. Agir, Bucureşti, 2002
2. Croitoru V., Constantinescu A. Metode de concentrare şi separare, Iaşi, Universitatea „Al. I. Cuza”, 1974
3. Duca Al. Chimie analitică cantitativă- manual practic, vol2, Institutul politehnic Iaşi, 1979
4. Ligia Stoica, Irina Constantinescu, ş.a. , Chimie generală şi analize tehnice, Ediţia II,Ed. Didactică şi Pedagogică, Bucureşti , 1991, pag.529-534.
5. Maria Pele, Chimie analitică şi analiză instrumentală, Ed. Matrix Rom, Bucureşti,1999, pag. 262-267.
6. Sonia Gutt, Analiza instrumentală, Ed. Universităţii Suceava, Suceava, 1997, pag.68-72.
7. http://www.jhc.org/cgi/reprint/23/12/941.pdf
8. http://www.aurorabiomed.com/aas.htm http://www.andor.com/learning/applications/Atomic_Spectroscopy/
9. http://www.who.int/water_sanitation_health/resourcesquality/wqmchap8.pdf
10. http://www.answers.com/topic/spectroscopy23
11. http://www.gmu.edu/departments/SRIF/tutorial/aas/aas.htm
12. http://www.chemistry.nmsu.edu/Instrumentation/AAS_HCL.html
13. http://www.cee.vt.edu/ewr/environmental/teach/smprimer/aa/aa.html
14. www_RegieLive_ro_DETERMINAREA_PLUMBULUI_SI_CADMIULUI_DIN_ALIMENTE_PRIN_SPECTOMETRIE_DE_ABSORBTIE.zip24
Preview document
Conținut arhivă zip
- Analiza chimica a alimentelor prin spectrofotometrie cu absorbtie chimica.docx